El fracaso de un físico y los misterios del ARN
Artículo basado en el libro: "El Catalizador: Cómo el ARN se convirtió en la clave del origen y el futuro de la vida" de Thomas R. Cech.
15 min read


Esta historia comienza con el reputado físico George Gamow. Nacido en 1904 en Odesa (Ucrania), Gamow comenzó a contemplar el universo a la temprana edad de 6 años, cuando observó el cometa Halley desde la azotea del edificio donde vivía con su familia. Cuatro décadas después se convertiría en el principal defensor de la teoría del Big Bang. Sus colegas científicos lo consideraban un genio, “otro Heisenberg”, dijo sobre el Niels Bohr, pero también un bicho raro, “un diablillo gigante que salta de los átomos a los genes y de ahí a los viajes espaciales”, afirmó sobre Gamow el codescubridor de la estructura del ADN Jim Watson. Tras pasar más de 20 años como profesor de física de la Universidad George Washington de Washington D.C., a cabo en la Universidad Boulder de Colorado. Sin embargo, sus futuras investigaciones en su nuevo puesto, poco tenían que ver con sus especialidades en física nuclear y cosmología; de hecho, no tenían nada que ver con la física. En junio de 1953, Gamow leyó en la revista Nature el trascendental artículo de Jim Watson y Francis Crick en el que anunciaron que la estructura del ADN era una doble hélice. Esta estructura ofrecía una solución a lo que durante mucho tiempo se había considerado un misterio: cómo se duplica la información genética para que pueda transmitirse de una generación a la siguiente.
Debido a la complementariedad entre bases del ADN (la adenina (A) se empareja con la timina (T) y la guanina (G) lo hace con la citosina (C)), al abrir la doble hélice de ADN cada lado tendría la información necesaria para dirigir a construcción del lado opuesto, ya que ambos lados son perfectamente complementarios, y por lo tanto, así era como se se replicaba la información genética según Watson y Crick. En una carta fechada el 8 de julio de 1953, Gamow felicitó a Watson y Crick por haber convertido a la biología en una de las “ciencias exactas”. Además, solicitó una audiencia con ellos para proponer una colaboración que abordara la siguiente gran cuestión que todo el mundo tenía en mente: ¿Cómo se leía la información codificada en esas cadenas de , T, G y C para crear, en última instancia, una mano, un corazón o un cerebro? Gamow sugirió que podía ayudar a Watson y Crick a utilizar la física y las matemáticas para descifrar este código genético. Como en aquella época Gamow era asesor de la marina, no solo buscó ayuda entre los químicos y físicos de distintas universidades, sino también de criptógrafos militares.
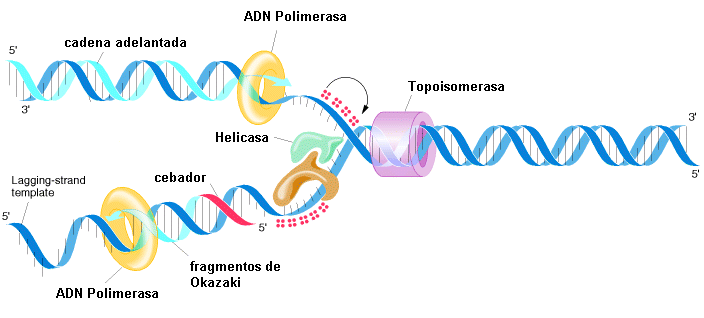

Proceso de la replicación semiconservativa del ADN (Fuente: Hipertextos del área de la Biología)
En términos biológicos “descifrar el código genético” significa entender cómo el ADN codifica las proteínas, ya que la vida se construye a partir de las proteínas, los principales motores de todos los organismos de nuestra biosfera. Algunas forman estructuras como las fibras musculares, el pelo o la piel; otras actúan como enzimas descomponiendo los alimentos que ingerimos en sus constituyentes; otras crean una serie de agujeros en las membranas plasmáticas de nuestras células, permitiendo la entrada selectiva de nutrientes y la expulsión de los desechos. Las hay que actúan como moléculas señalizadoras recibiendo información del mundo exterior y activando procesos internos en consecuencia. Otras son anticuerpos que nos protegen de los agentes patógenos, y así en un sin fin de funciones necesarias para la vida de cualquier organismo. Desde un punto de vista puramente químico, las proteínas son un polímero compuesto de cientos o incluso miles de aminoácidos. Existen 20 tipos diferentes de aminoácidos que muestran un orden específico o secuencia a lo largo de la cadena de cada proteína, esto es lo que se conoce como la estructura primaria de las proteínas. En función de esta secuencia, las proteínas se pliegan de una determinada forma creando una estructura tridimensional con una función particular. Además, cada una de estas miles de proteínas distintas, están codificadas por su propio gen, que está hecho de ADN.
Mientras que las proteínas están formadas por 20 aminoácidos, el ADN está formado por 4 bases (A, T, C y G). Gamow trataba de averiguar cómo las diferentes disposiciones de las 4 bases del ADN, especificaban o codificaban cada uno de los 20 aminoácidos. En 1954, Gamow ya había reclutado a Watson y Crick para llevar a cabo esta tarea, junto a un ecléctico grupo de 20 científicos, uno por cada aminoácido. Gamow mandó tejer 20 corbatas de lana, con una hebra de ARN, para cada uno de los miembros de esta pequeña fraternidad de intelectuales bautizada como “el Club de la Corbata de ARN”. Pero, ¿por qué de ARN y no de ADN? Fue Watson el que convenció a Gamow de centrar sus investigaciones en el ARN debido a la estructura básica de las células. En los organismos eucariotas (como nosotros, las plantas o los hongos) el ADN se encuentra en el núcleo celular, pero las proteínas se fabrican en los ribosomas, fuera del núcleo en una región conocida como citoplasma. Esta separación espacial obligaba a que algún tipo de mensajero transporte la información desde el ADN hasta el lugar de producción de las proteínas, y el ARN era una de los principales candidatos debido a que se encontraba en grandes cantidades tanto en el núcleo como en el citoplasma. Ya desde principios del siglo XX, se había descubierto que el ARN y el ADN mostraban una estructura bioquímica muy similar; de hecho sus nombres, ácido ribonucleico (ARN) y ácido desoxirribonucleico (ADN) ya nos indican que ambas moléculas son muy similares salvo que el ADN tiene un átomo menos de oxígeno que el ARN, por eso lo de “desoxi”. Esto hace que el ARN sea químicamente mucho menos estable que el ADN.
El ADN se convirtió en una pieza central de la biología en 1944, cuando Oswald Avery y sus colaboradores del Instituto Rockefeller descubrieron que el ADN era la molécula responsable de los cambios hereditarios que se producían en las bacterias. Para 1947, los científicos ya habían teorizado que el ARN era una copia del ADN, por lo que debía desempeñar un papel importante en la química de la vida. Aunque el ARN sea monocatenario (una sola cadena) y el ADN bicatenario (dos cadenas), ambos hablan el mismo idioma. El ARN, al igual que el ADN, se escribe con un alfabeto de 4 letras, en donde 3 son las mismas que en el ADN (A, G y C) mientras que la cuarta, el uracilo (U) ocupa el mismo lugar en el alfabeto del ARN que la Timina en el del ADN. Pero en cualquier caso, cuando el ARN se copia del ADN, ambos portan la misma información.
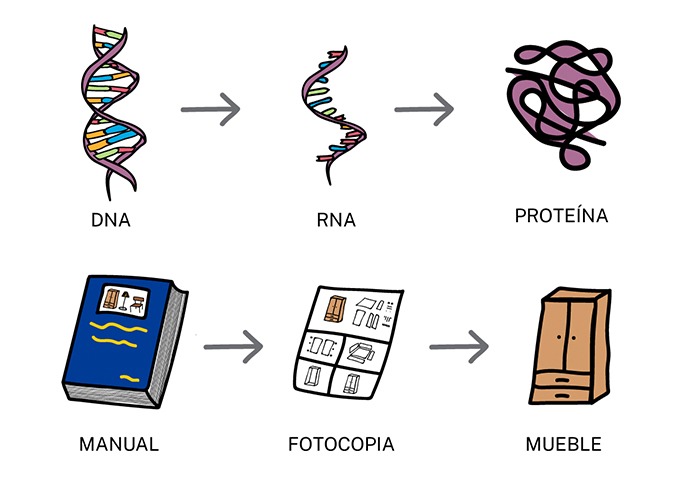
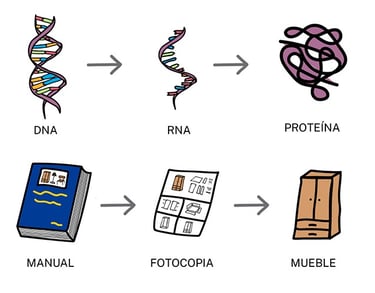
Esquema simplificado de los procesos de transcripción (ADN > ARN) y traducción (ARN > Proteína) (Fuente: ADNinstitut)
Gamow trató primero de encontrar la solución al problema de la codificación usando solo papel y lápiz. En 1953, el mismo año de descubrimiento de la estructura de la doble hélice, Gamow ya planteó (acertadamente) que 3 bases de ADN codificarían un aminoácido. ¿Cómo lo hizo? Mediante un razonamiento matemático muy sencillo. Es evidente que como solo hay 4 bases, es imposible que cada una de ellas codifique cada uno de los 20 aminoácidos. Si fueran dos bases, las posibles combinaciones que se podrían generar con las 4 bases serían 16, por lo que dos no son suficientes. Pero cuando intentamos ordenar las 4 letras del alfabeto del ADN (A, C, G y T), en combinaciones de 3 bases, obtenemos 64 disposiciones diferentes, las cuales son suficiente para especificar los 20 aminoácidos. Aunque es cierto que grupos de bases más largas podían hacer el trabajo, con 3 había suficiente. Era el formato más económico para el código genético. Ahora era necesario averiguar qué grupos de 3 bases codificaban cada uno de los 20 aminoácidos. Aunque Gamow había reunido a varios de los mayores genios del siglo XX, los distinguidos miembros del Club de la Corbata del ARN llegaron a un callejón sin salida al intentar responder a esta cuestión. Para finales de la década de 1950, Gamow ya había renunciado a descifrar el código, convencido de que el problema “no tenía una solución” que pudiera encontrarse “sobre la base de la teoría pura”. Lo que Gamow estaba buscando era la piedra Rosetta de la biología, pero en lugar de un texto escrito tanto en griego como en jeroglíficos egipcios, debería mostrar la secuencia de aminoácidos de una proteína, junto a la secuencia de ARN que la codifica. Sin embargo, no existía semejante piedra, por lo que los científicos debían inventar una. Y, para ello, primero habían de determinar si el ARN era realmente el mensajero entre la secuencia de bases del ADN y la secuencia de aminoácidos de las proteínas.
Cuando en la década de 1950 los científicos trataron de encontrar pruebas empíricas de que el ARN es el mensajero de la vida, sus resultados iniciales fueron desalentadores. El primer fracaso llegó cuando los científicos descubrieron que el ARN presente en el citoplasma tenía la misma proporción de bases de A, G, C y U, con independencia de las proteínas que sintetizan. Sería como descubrir que la Novena Sinfonía de Beethoven tiene exactamente la misma proporción de cada nota musical que una canción de Bad Bunny. Es lógico pensar que 2 composiciones musicales tan dispares tengan distribuciones distintas de sus notas, y lo mismo ocurre con las proteínas. También es lógico pensar que 2 proteínas con funciones tan diferentes como la hemoglobina o la insulina (por ejemplo) presentan unas proporciones de aminoácidos distintas y, por lo tanto, las hebras de ARN que las codifican muestran también proporciones de A, C, G y U diferentes. Sin embargo, no era esto lo que indicaban los experimentos. La segunda decepción llegó cuando se observó que las moléculas de ARN del citoplasma son muy estables, con una vida muy larga. Sin embargo, los experimentos también habían demostrado que las proteínas que se fabrican en una célula cambian rápidamente. Por ejemplo, cuando se modifica la fuente de alimento de un cultivo de bacterias, estas dejan de producir las enzimas necesarias para digerir el antiguo alimento y fabrican nuevas proteínas que les permitan digerir la nueva fuente de nutrientes. Si el ARN era el precursor de las proteínas, ¿no debería cambiar igual de rápido? El ARN debía de ser inestable para permitir los cambios en la producción de proteínas.


Algunos miembros del Club de la Corbata del ARN, entre los que destacan Crick (arriba a la izquierda) y Watson (abajo a la derecha) (Fuente: ULUM)
Francis Jacob y Jacques Monod, del Instituto Pasteur de París, llevaban tiempo investigando la activación y la desactivación de genes en bacterias, pero pasaron a centrarse en el estudio del ARN como precursor de las proteínas. En 1960, durante una visita a Cambridge, Jacob se reunió con sus amigos Francis Crick y Sydney Brenner. Cuando Jacob describió sus últimos experimentos sobre la forma en la que se regulan los genes en bacterias, de forma simultánea, Crick y Benner dieron un respingo al recordar los recientes experimentos de los científicos Ken Volkin y Larry Astrachan. Este estudio se basaba en la infección de E. coli con un fago (virus de las bacterias) llamado T2, dónde habían observado que tras la infección, se formaban nuevos ARN a una gran velocidad. Estas moléculas de ARN eran más pequeñas e inestables que los ARN observados hasta ese momento. Hoy en día sabemos que estos ARN estables están incrustados en los ribosomas y son otro tipo distinto del ARN que estaban buscando, denominado ARN ribosómico. El ARN que trataban de encontrar era el que hacía de mensajero entre el ADN y las proteínas, por lo que se denominó ARN mensajero o ARNm. ¿Habían observado Volkin y Astrachan el escurridizo ARNm? Era una posibilidad que bien merecía su investigación. Con la intención de encontrar las agujas de ARNm en el pajar de ARN ribosómico, Brenner y Jacob se juntaron con Matt Meselson de Caltech, para emplear una ultracentrifugadora en la tarea. El plan consistía en infectar E. coli con un fago, para que las bacterias cambiaran el tipo de proteínas que producían. Al mismo tiempo que se añadía el fago, los científicos añadían una versión radioactiva del uracilo (marcado con C14) que se incorporaría solo al ARNm recién producido tras la infección, no a los ARN ribosómicos preexistentes. Si su hipótesis era correcta, el ARNm radioactivo del fago aparecería justo en ese momento, lo que les permitiría encontrar el eslabón perdido entre el ADN y las proteínas. Y esto fue exactamente lo que ocurrió.
Brenner, Jacob y Melson detectaron el ARNm radiactivo en la centrifugadora, y tal y como se esperaba, era más pequeño que el ARN ribosómico y mucho más inestable, con una vida muy efímera. Además, observaron cómo este ARN se unía a los ribosomas (las fábricas de proteínas de las células), confirmando su hipótesis. La principal razón de la dificultad de la tarea, residía en que tan solo el 5% del ARN de E. coli es ARN mensajero, el otro 95% es sobre todo ribosómico. Y por si esto no fuera poco, el ARNm de E. coli tenía una vida útil de unos pocos minutos, lo que complicaba aún más la tarea. Por el contrario, el ARN ribosómico no sólo es muy abundante, sino que también es muy longevo, por lo que es sencillo entender que los primeros científicos que estudiaron este tema, tardaron tanto en ver más allá de todo ese ARN ribosómico. Ya se había confirmado que el ARNm actuaba como mensajero entre el ADN y las proteínas, ahora solo faltaba averiguar el alfabeto que empleaba; es decir, conocer las 3 bases que codifican cada uno de los 20 aminoácidos. En los albores de la década de 1960, el código genético seguía siendo indescifrable, hasta que apareció un joven científico llamado Marshall Nirenberg.
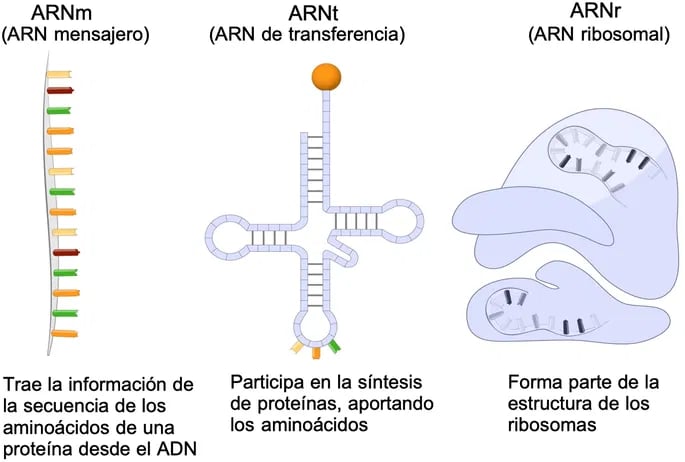
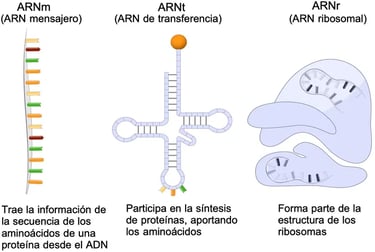
Los 3 tipos principales de ARN (Fuente: Enciclopedia Significados)
Antes de dedicarse a la bioquímica y obtener su doctorado, Nirenberg ya había cursado un Máster en la Universidad de Florida estudiando tricópteros, un grupo de insectos cuyas larvas son acuáticas, pero que en su estado adulto son muy similares a las polillas. Como Nirenberg tenía poca relación con el club de la corbata de ARN, pudo apartarse del enfoque teórico de Gamow, y enfocar el problema desde un punto de vista bioquímico. Para ello sería necesario recrear la síntesis proteica (proceso en el que el ARNm se convierte en proteínas) dentro de un tubo de ensayo. Ya existía un pionero método para la síntesis de proteínas fuera de las células utilizando ingredientes obtenidos a partir de hígados de rata, y posteriormente, otros científicos demostraron que se podía utilizar extractos de E. coli para hacer lo mismo. El método consistía en romper las bacterias de E. coli para obtener una preparación bruta de ribosomas y, a continuación, añadir diferentes secuencias de ARNm a modo de moldes para obtener proteínas. En un inicio, Nirenberg y su becario (Heinrich Matthaei) descubrieron que una molécula de ARN compuesta íntegramente por bases de Uracilo (U), conocida como poli(U), dirigía la síntesis de una única proteína compuesta en su totalidad por el aminoácido fenilalanina. Así se descifró la primera pieza del rompecabezas del código genético: el triplete de bases UUU codifica el aminoácido fenilalanina. El siguiente paso a seguir era evidente, sintetizar moléculas de ARNm compuestas exclusivamente de las bases de citosina (C) o poli(C), de guanina (G) o poli(G) y de adenina (A) o poli(A). Esto permitió descubrir las siguientes 3 palabras del alfabeto de la vida: CCC → Prolina, AAA → Lisina y GGG → Glicina. Ya disponíamos del significado de 4 de las 64 combinaciones posibles, solo faltaban 61. Sin embargo, las 4 primeras “palabras” descifradas estaban compuestas de una sola base, por lo que el resto requeriría un enfoque diferente.
Este es el momento de hablar de Gobin Khorana. Nacido en el seno de una humilde familia hindú de Raipur (entonces la India pero ahora Pakistán) estudió en Inglaterra y Suiza. Saltó a la fama por su trabajo descifrando el código de la vida gracias a un método que inventó con su equipo en el que sintetizaban ADN añadiendo nucleótidos de uno en uno. Luego, mediante una enzima recién descubierta este ADN era copiado a ARN, permitiendo obtener una secuencia de bases de ARN con total precisión. Estos ARN fueron empleados como mensajeros para especificar las secuencias de aminoácidos que correspondían a cada triplete de bases. Khorana sintetizó todas las permutaciones posibles de tres bases (las 64) y las introdujo en el sistema de síntesis de proteínas observando la cadena de aminoácidos que se obtenía. De esta forma, ayudó a completar la tabla del código genético, lo que le valió el Premio Nobel de Fisiología o Medicina en 1968 junto a Nirenberg. Tras leer sobre estos descubrimientos, Gamow se sintió satisfecho de que alguien hubiese podido resolver el problema de la codificación, aunque no pudo evitar criticar el enfoque experimental: “La solución parece bastante menos elegante que la simple correlación teórica que yo había visualizado en un principio. Pero tiene la indiscutible ventaja de ser correcta” dijo el físico.
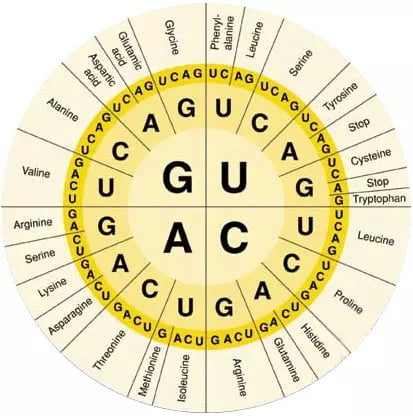
Código genético en el que se observa que aminoácidos codifican cada una de las 64 posibles combinaciones de 3 pares de bases (Fuente: Xataka)
Dilucidar el código que utiliza el ARN mensajero para especificar las proteínas fue todo un logro, pero no era la única gran pregunta que había que responder, ¿cómo conseguía el ARNm colocar los aminoácidos en la posición correcta para encadenarlos y construir una proteína? Por increíble que parezca, Francis Crick hizo un planteamiento teórico para responder a esta pregunta en una fecha tan temprana como 1955, y su postulado resultó ser correcto. Crick propuso que debía existir una molécula (que nunca se había visto antes) que actuase como adaptador. Imagina un grupo de moléculas con dos extremos, uno estaría unido a uno de los 20 aminoácidos, y el otro reconocería y se uniría al triplete de bases (o codón) de ARNm correspondiente. Sin siquiera saberlo, Crick había postulado de forma correcta la existencia de una nuevo tipo de ARN, el ARN de transferencia (ARNt). Como el codón del ARNm era complementario al anticodón del ARNt, ambos se unirían por complementariedad de bases, y con sus aminoácidos correspondientes el ARNm iría creando la secuencia de aminoácidos correcta gracias al ARNt. Sin embargo, en un principio, esto era pura teoría, y alguien debía demostrarlo en el laboratorio. Ese alguien fue Paul Zamecnik, que ya ha aparecido en esta historia como el creador del método de síntesis de proteínas a partir del hígado de rata. Zamecnik comenzó marcando radiactivamente los aminoácidos para poder seguir su rastro. Cuando Zamecnik añadió estos aminoácidos radioactivos a su sistema de hígado de rata, descubrió que pequeños ARN se volvían radioactivos, lo que indicaba que los aminoácidos se habían unido a un ARN. Aunque nunca se había observado una unión de este tipo, esto era exactamente lo que ocurriría si existiera la molécula adaptadora que había previsto Crick. Tiempo después, estos ARN fueron bautizados como ARN de transferencia o transferentes.
A mediados de la década de los 60, a algunos científicos les pareció que la historia del ARN había terminado. Cada ARNm obtenido a partir del ADN nuclear dirige la síntesis de una proteína, y en este proceso, participan otros dos ARN más estables: el ARNt que conectaba cada codón de ARNm con el aminoácido correspondiente, y el ARN ribosómico (ARNr) que construye la proteína. Incluso a día de hoy mucha gente versada en la materia cree que el ARN solo sirve para lo que acabo de explicar. Sin embargo, aunque estos procesos sean esenciales para la supervivencia de todos y cada uno de los organismos de la Tierra, resulta que esta función de mensajería es sólo el primero de los muchos superpoderes del ARN. Si quieres descubrir el resto, te recomiendo la lectura del libro en el que se basa este artículo, ya que en él se describe todo el potencial de estas pequeñas y ya no tan misteriosas moléculas.
Artículo basado en:






